이온 결합력은 양이온과 음이온 사이에서 작용하는 정전기석 인력입니다.
이렇게 쿨롱의 법칙으로 수식을 표현할 수 있습니다.
$$ F = k \frac{q_{1} \cdot q_{2}}{r^2} $$
(q1,q2 : 두 이온의 전하량 r : 두 이온 사이의 거리)
이온 결합력의 세기는 다음과 같이 비교합니다.
1. 이온의 전하량이 클수록 이온 결합력이 세다.
ex)NaF와 MgO를 비교 해 보겠습니다.
Na의 전하량 : +1
F의 전하량 : -1
Mg의 전하량 : +2
O의 전하량 : -2
MgO가 더 전하량이 크니 더 셉니다.
2. 이온의 거리가 가까울수록 이온 결합력이 세다.
이온 반지름하고 관계가 있습니다. 이온 반지름이 작아지면, 거리도 가까워집니다.
ex) 이온 사이의 거리 : LiCl < NaCl
(같은 족에서는 원자 번호가 클수록 이온 반지름이 커집니다.)
이온 결합력 : LiCl > NaCl
**이온 결합력이 세면 녹는점과 끓는점도 높습니다.**
이온 결합 물질은 다음과 같은 성질을 갖습니다.
이온 결합 물질은 대체로 녹는점과 끓는점이 높아, 상온에서 고체 상태로 존재합니다.
물에도 잘 용해됩니다. 그 이유는 물은 극성을 띄기 때문에 그렇습니다.
(단 AgCl, CaSO4와 같은 앙금은 물에 잘 용해되지 않습니다.)
전기 전도성은 고체냐 액체냐에 따라서 약간 달라집니다.
고체일 경우에는, 이온이 이동하지 않기 때문에 전기 전도성을 띄지 않습니다.
반면 액체나 수용액일 경우에는, 이온이 이동을 하기 때문에 전기 전도성을 띄게 됩니다.
수용액에서 음이온은 (+)로, 양이온은 (-)로 이동합니다.
이온은 단단하지만, 망치로 부수면 잘 부서집니다.
그 이유는 다음과 같습니다.
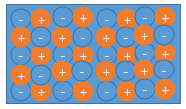
결정이 이렇게 있다고 해 보겠습니다.
망치로 때린다고 가정해 보겠습니다.

[그림 2]를 보면, 부서진 곳에서 (-)와 (-)가 만나고 (+)와 (+)가 만나는 것을 보실 수 있습니다.
같은 극끼리 만나면 반발력이 작용해 두 물체가 밀어내는데, 이것도 마찬가지로 이 이유 때문에 쉽게 떨어지는 것입니다.
'화학 > 화학 결합' 카테고리의 다른 글
| [화학] 화학 결합 - 이온 결합 형성 (0) | 2022.10.04 |
|---|---|
| [화학] 화학 결합 - DNA의 구조 (0) | 2022.10.04 |
| [화학] 화학 결합 - 탄소의 동소체 (1) | 2022.10.04 |



댓글